|
|
作者:孟俊1, 彭奕冰1, 张冬青2
单位:1.上海交通大学医学院附属瑞金医院检验科, 2.上海交通大学医学院上海市免疫学研究所
脑脊液(cerebrospinal fluid, CSF)中免疫检验指标, 特别是免疫球蛋白成分及其含量的检测, 对某些中枢神经系统(central nervous system, CNS)疾病的诊断、发病机制研究、疗效观察和预后判断具有重要意义[1]。CSF中寡克隆区带(oligoclonal band, OCB)的测定可以定性地反映鞘内免疫球蛋白的合成。以往国内相关研究仅检测CSF中的OCB, 由于血脑屏障的破坏, 可导致出现假阳性。若配对分析CSF和血清中的OCB, 得到CSF-OCB的结果, 可排除血脑屏障的影响。用等电聚焦加免疫标记的方法检测CSF-OCB, 现已成为国际公认的判定是否存在鞘内免疫球蛋白合成的金标准[2, 3, 4]。
一、OCB的产生机制
1959 年, 有学者用琼脂糖凝胶电泳法从亚急性硬化性全脑炎患者CSF γ 球蛋白中分离出几个光密度不同的条带; 1960 年, KUTT 也发现多发性硬化症(multiple sclerosis, MS)患者 CSF 电泳后在靠近阴极端形成狭窄而不连续的区带; 1971年, 由 link 用免疫电泳法证实这些区带是由浆细胞克隆激活分泌的IgG 分子进入CSF而构成, 并命名为OCB IgG 区带[5]。正常人体内, 由无数种克隆株合成的免疫球蛋白, 电泳时在γ 球蛋白区域形成均匀连续的区带谱, 称为多克隆免疫球蛋白区带。但在疾病情况下, 某几个克隆株浆细胞异常增生, 合成的免疫球蛋白在电泳时可在γ 球蛋白区域形成几个狭窄且不连续的区带谱, 即为OCB[6]。OCB是数个B细胞系株(克隆)在CNS局部产生的特殊抗体, 因此关于OCB 产生的机制, KARUSSIS等[7]提出是由于内源性 B 细胞遗传的异常, 选择性地使某些 B 细胞克隆增强转录, 引起增殖并导致免疫球蛋白失衡。OCB 以IgG为主, 也可出现IgM或IgA。CSF中OCB的出现往往高度提示有免疫球蛋白的鞘内合成。但在某些疾病情况下, 由于血脑屏障遭破坏, 活化的B细胞由血液进入CNS, 导致血清和CSF中均含有相同的OCB。因此, 配对检测血清和CSF中的OCB可以更准确地判定CNS内是否存在免疫球蛋白的局部合成[8]。
二、OCB的检测方法
1. 聚丙烯酰胺凝胶电泳银染色法 将待测CSF或血清样本进行电泳分离, 经染色后观察。此法较简便, CSF无需浓缩, 便于一般临床实验室开展。但该法敏感性和阳性率均较低, 缺乏IgG特异性, 已被MS 国际专家组及美国食品和药品管理局淘汰[9]。
2. 等电聚焦结合免疫印迹检测 在电解槽中加入两性电解质, 通以直流电, 形成由阳极至阴极逐渐增加的pH 梯度, 将CSF与稀释后的对照血清依次点加在阳极, 根据蛋白质分子的等电点不同, 经电泳不同蛋白组分即可移动并聚焦于其等电点 pH 位置, 经染色可在阴极观察结果。该法比聚丙烯酰胺凝胶电泳银染色法特异性好、敏感性高、分辨率好。等电聚焦结合免疫印迹检测是目前国际公认的判定CSF-OCB 的金标准, 在临床应用最广泛[9, 10]。
3.OCB结果判断 常见的CSF-OCB 5种图型见图1。
三、OCB与中枢神经脱髓鞘疾病
1. MS 早在20世纪40年代初, ELVIN KABAT最早阐述了免疫球蛋白IgG的理化特性, 发现MS患者CSF中选择性的γ 球蛋白增加, 主要是IgG部分增加, 而血中无相应变化, 证明了IgG是由CNS鞘内抗体合成的, 由此提出了MS的发病机制与免疫功能异常有关。CSF-OCB阳性是判定鞘内IgG合成的定性指标, 为MS早期诊断提供了重要的实验室依据, 因此POSER在1983年的MS诊断标准中就已经把CSF-OCB阳性作为重要的辅助检查。在2005年修订的MS诊断标准中再次确定了CSF-OCB阳性的重要诊断意义[12]。
寡克隆区带检测在中枢神经系统疾病诊断中的应用
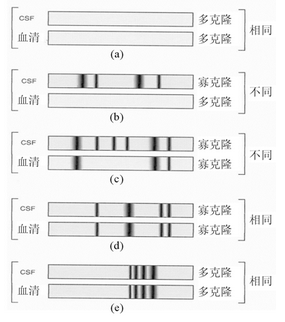
图1 常见的CSF-OCB
注:(a)患者CSF及血清样本中都未出现OCB, 提示患者CNS未出现相关的免疫性疾病; (b)CSF样本中出现狭窄的、不连续的OCB, 而血清样本相对应的位置并无区带, 提示存在IgG鞘内合成; (c)患者CSF及血清样本均出现了同样的条带, 且CSF还存在额外的区带, 显示同时存在血脑屏障损伤及IgG鞘内合成; (d)CSF及血清样本均出现了完全相同的OCB, 提示存在血脑屏障损伤; (e)CSF及血清样本出现了完全相同的连续均一的条带, 为单克隆区带。虽然(b)、(c)、(d)和(e)图均提示产生了体液免疫反应, 但仅(b)和(c)图提示存在IgG鞘内合成, 是反映CNS病变的重要标志, 可以判断为阳性结果[11]
文献所报道的MS患者CSF-OCB阳性率一般在56%~97%, 西方国家确诊MS患者OCB阳性率为90%~95%, 而东方国家MS患者OCB阳性率普遍低于西方国家, 日本为56.1%, 我国上海华山医院报道为39.6%[13]。我国MS患者CSF-OCB阳性率偏低的原因:(1) 可能与东方人MS的临床类型分布有关。我国MS患者中, 视神经脊髓炎型MS的发病率远比西方国家高, 而视神经脊髓炎型MS患者OCB阳性率又比较低。有学者曾报道视神经脊髓炎型MS患者OCB阳性率为27%, 日本学者报道视神经脊髓炎型MS患者OCB阳性率为22.0%~28.6%, 我国上海华山医院报道视神经脊髓炎型MS患者OCB阳性率仅为21.9%。因此东方人的特殊MS临床类型可能是东方国家, 包括中国、新加坡及日本等MS患者OCB阳性率较低的原因之一[14]。(2)可能与免疫遗传性有关。有研究对传统MS中OCB阴性及阳性患者分别进行人类白细胞抗原(human leucocyte antigen, HLA)分型, 结果发现OCB阳性患者多为HLA-DR2、DR15型, 而OCB阴性患者多为HLA-DR4型, 表明OCB阳性率高低可能与我国人群的免疫遗传特点相关[15]。
OCB阳性虽然不能作为诊断MS的直接证据, 但对MS的早期诊断和预后判断均具有重要意义。有临床研究表明, 在MS早期、急性期、进展期OCB阳性率均较高, 活动期MS患者OCB阳性率明显高于非活动期患者。因此OCB的出现对判断MS疾病进程、病情的严重程度、病灶活动期或非活动期等具有重要的临床意义。有文献通过对MS患者头颅核磁共振的研究发现了OCB阳性率的高低与病灶部位也有一定关系。有学者报道日本OCB阳性MS患者, 胼胝体和脑室周围的病灶出现率较高; 而OCB阴性MS患者的病灶多位于皮质下白质部位, 表现为弥漫的白质病灶或少量小白质病灶, 并且幕下病灶少见。此可能与病灶距离脑室系统较远, CSF中不易检测到OCB有关[16]。另外有临床研究发现, OCB阴性患者其临床症状相对较轻, 可能与皮质下白质部位神经细胞密度相对稀疏, 受损累及的神经细胞相对较少有关[17, 18]。上述研究均表明OCB与脑部病灶部位及临床症状轻重可能有一定的相关性。
2. 视神经脊髓炎 视神经脊髓炎是临床常见的一种自身免疫性疾病, 其临床特征为急性或亚急性起病后引发单眼或双眼失明, 同时伴有不同程度的横贯性或上升性脊髓炎, 不受年龄的限制, 21~41岁青壮年高发, 治疗缓解后也可复发。临床上认为视神经脊髓炎是针对体内水通道蛋白4的血清IgG自身抗体阳性的一种自身免疫性离子通道疾病, 而MS是以辅助性T细胞免疫为主的一种炎性脱髓鞘疾病, 2种疾病在本质上有区别[19], 且视神经脊髓炎患者CSF中OCB的发生率较高。纵向病灶也往往超过3个椎体节段, 2种疾病均为女性高发。ZAFFARONI 等[20]研究视神经脊髓炎患者CSF中多核细胞数及 OCB, 发现在视神经脊髓炎的急性期, 患者CSF中多核细胞数> 50× 106/L时OCB呈阳性, 但随着时间的推移, OCB 很快消失, 这不同于MS患者。因此, 对视神经脊髓炎患者CSF中OCB的检查应选择在急性期进行, 而且需要重复测定, 以提高检出的阳性率[21]。
3. 吉兰-巴雷综合征(Guillain-Barré syndrome, GBS) GBS的确切发病机制尚未明了, 但存在免疫功能障碍已成为共识。多篇文献报道GBS患者CSF-OCB阳性率以及IgG指数明显高于其他CNS非炎症性疾病。亦有研究发现GBS患者IgG I较对照组明显增高。这些研究提供了鞘内合成免疫球蛋白的证据, 说明至少部分免疫球蛋白是免疫活性细胞被激活的结果。因此测定CSF和血清的OCB可以定性地反映鞘内合成的免疫球蛋白, 对GBS具有重要的辅助诊断价值[22] 。
四、结语
总之, 目前临床上对于CNS疾病特别是脱髓鞘病的诊断主要依赖影像学检查和临床表现进行分析, 但由于此类疾病在早期病理学改变并不明显, 影像学检查和常规检查并不能有效地及时发现, 由于CSF IgG的增加发生较早, 所以对患者血清和CSF同时进行电泳以检测OCB是否存在, 同时结合其他免疫学指标如IgG指数、24 h IgG合成率、病毒感染抗体及分子生物学指标, 是早期诊断CSF疾病的有效途径。
参考文献
[1] DEISENHAMMER F, BARTOS A, EGG R, et al. Guidelines on routine cerebrospinal fluid analysis. Report from an EFNS task force[J]. Eur J Neurol, 2006, 13(9): 913-922.
[2] ANDERSSON M, ALVAREZS-CERMENO J, BERNARDI G, et al. Cerebrospinal fluid in the diagnosis of multiple sclerosis: a consensus report[J]. J Neurol Neurosurg Psychiatry, 1994, 57(8): 897-902.
[3] SOUVERJIN JH, SERREE HM, PEET R, et al. Intrathecal immunoglobulin synthssis. Comparison of various formulae with the 'gold stand ard' of isoelectric focusing[J]. J Neurol Sci, 1991, 102(1): 11-16.
[4] CORREALE J, DE LOS MILAGROS BASSANI MOLINAS M. Oligoclonal band s and antibody responses in multiple sclerosis[J]. J Neurol, 2002, 249(4): 375-389.
[5] HOLMOY T. The discovery of oligoclonal band s: a 50-year anniversary[J]. Eur Neurol, 2009, 62(5): 311-315.
[6] DISANTO G, MORAHAN JM, BARNETT MH, et al. The evidence for a role of B cells in multiple sclerosis[J]. Neurology, 2012, 78(11): 823-832.
[7] KARUSSIS D, VOURKA-KARUSSIS U, MIZRACHI-KOLL R, et al. Acute/relapsing experimental autoimmune encephalomyelitis: induction of long lasting, antigen-specific tolerance by syngeneic bone marrow transplantation[J]. Mult Scler, 1999, 5(1): 17-21.
[8] SKOV AG, SKOV T, FREDERIKSEN JL. Oligoclonal band s predict multiple sclerosis after optic neuritis: a literature survey[J]. Mult Scler, 2011 , 17(4): 404-410.
[9] PETZOLD A. Intrathecal oligoclonal IgG synthesis in multiple sclerosis[J]. J Neuroimmunol, 2013, 262(1-2): 1-10.
[10] 吕礼应. 免疫透射比浊测定脑脊液免疫球蛋白[J]. 检验医学, 2003 , 18(4): 223-225.
[11] FRANCIOTTA D, BERGAMASCHI R, AMATO MP, et al. Clinical correlations of CSF single IgG band s[J]. J Neurol, 2005, 252(10): 1274-1275.
[12] POLMAN CH, REINGOLD SC, EDAN G, et al. Diagnostic criteria for multiple sclerosis: 2005 revisions to the"McDonald Criteria"[J]. Ann Neurol, 2005, 58(6): 840-846.
[13] 方明, 乔健. 寡克隆区带和IgG指数对多发性硬化的诊断价值[J]. 临床神经病学杂志, 2004, 17(4): 247-249.
[14] NAKASHIMA I, FUJIHARA K, MISU T, et al. A comparative study of Japanese multiple sclerosis patients with and without oligoclonal IgG band s[J]. Mult Scler, 2002, 8(6): 459-462.
[15] FUKAZAWA T, KIKUEHI S, SASAKI H, et al. The significance of oligoclonal band s in multiple sclerosis in Japan: relevance of immunogenetic backgrounds[J]. J Neurol Sci, 1998 , 158(2): 209-214.
[16] KIKUCHI S, FUKAZAWA T, NIINO M, et al. HLA-related subpopulations of MS in Japanese with and without oligoclonal IgG band s. Human leukocyte antigen[J]. Neurology, 2003, 60(4): 647-651.
[17] NAKASHIMA I, FUJIHARA K, MIYAZAWA H. Relevance of callosal and periventrieular MRI lesions to oligoelonal band s in multiple sclerosis[J]. Acta Neurol Scand , 2006, 113(2): 125-131.
[18] HUTTNER HB, SCHELLINGER PD, STRUFFERT T, et al. MRI criteria in MS patients with negative and positive oligoclonal band s: equal fulfill-ment of Barkho's criteria but different lesion patterns[J]. J Neurol, 2009, 256(7): 1121-1125.
[19] DOBSON R, RAMAGOPALAN S, DAVIS A, et al. Cerebrospinal fluid oligoclonal band s in multiple sclerosis and clinically isolated syndromes: a meta-analysis of prevalence, prognosis and effect of latitude[J]. J Neurol Neurosurg Psychiatry, 2013, 84(8): 909-914.
[20] ZAFFARONI M. Cerebrospinal fluid fingings in Devic's neuromyelitis optica[J]. Neurol Sci, 2004, 25(Suppl 4): S368-S370.
[21] JURYN'CZYK M, CRANER M, PALACE J. Overlapping CNS inflammatory diseases: differentiating features of NMO and MS[J]. J Neurol Neurosurg Psychiatry, 2015, 86(1): 20-25.
[22] MOULIN D, PATY DW, EBERS GC. The predictive value of cerebrospinal fluid electrophoresis in 'possible'multiple sclerosis[J]. Brain, 1983, 106(Pt 4): 809-816. |
|
 |关于我们|医维基|网站地图|Archiver|手机版|医疗之家
( 沪ICP备2023001278号-1 )
|关于我们|医维基|网站地图|Archiver|手机版|医疗之家
( 沪ICP备2023001278号-1 )