|
作者:王东江 综述1, 吴文娟 审校2
单位:1.同济大学医学院,2.同济大学附属东方医院南院医学检验科
外阴阴道念珠菌病(vulvovaginal candi-diasis, VVC)曾称为霉菌性阴道炎、外阴阴道假丝酵母菌病等, 是由念珠菌引起的女性生殖道感染性疾病, 其病原菌是以白念珠菌为主的酵母菌, 其他如光滑念珠菌、热带念珠菌、近平滑念珠菌等非白念珠菌占少数[1]。作为女性生殖道感染最常见的原因之一, VVC在世界范围内常见, 影响社会各阶层的女性健康。然而, 由于环境污染、过度的非处方抗真菌药物的应用、不规范治疗等, 干扰了无症状念珠菌携带者和VVC的诊断与治疗[2]。目前认为VVC的发病和复发与多种因素有关, 如念珠菌耐药性的不断增加, 宿主对抗念珠菌的局部免疫反应变化, 念珠菌毒力因子的变化等。伴随着诊断方法的进步, VVC的分类和治疗也越来越精准。
一、VVC的流行病学特征及临床分类
到目前为止, VVC的患病率尚不明确, 但有着较高的发病率和复发率[2]。现有资料表明, 70%~75%的女性一生中至少患VVC 1次, 40%~50%患有VVC的女性会有复发感染, 生育期年龄的女性发病最频繁。VVC是阴道感染的第2个最常见的原因, 仅次于细菌性阴道炎[3, 4, 5]。念珠菌有较高的阴道内定植率, 约20%的健康无症状女性阴道中可以分离出念珠菌, 孕期女性增加到30%[3, 6]。WATSON等[7]研究显示, 高达37%的女性阴道内有念珠菌定植。
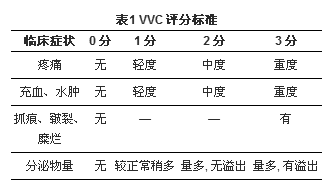
VVC分为单纯性VVC和复杂性VVC。单纯性VVC为正常非孕期女性散发、偶发的由白念珠菌所引起的轻或中度VVC。复杂性VVC包括复发性VVC(recurrent vulvovaginal candidiasis, RVVC), 重度VVC, 妊娠期VVC, 非白念珠菌引起的VVC或未控制的糖尿病患者、免疫低下者VVC。RVVC通常定义为1年内有症状的VVC发作4次或4次以上, 约5%的女性患有RVVC。RVVC的发病机制尚不清楚, 大多数患有RVVC的妇女没有明显的诱因。重度VVC 是指临床症状严重, 外阴或阴道皮肤黏膜有破损, 按VVC评分标准[1, 8], 评分≥ 7分者。见表1。
外阴阴道念珠菌病研究进展
二、病原学
1.病原微生物 念珠菌作为正常菌群的一部分存在于皮肤表面、消化道和泌尿生殖道, 定植和致病的机制尚不清楚。VVC常见的病原菌有白念珠菌、热带念珠菌、近平滑念珠菌、克柔念珠菌、季也蒙念珠菌、葡萄牙念珠菌、乳酒念珠菌、都柏林念珠菌和光滑念珠菌等。白念珠菌是VVC的主要病原菌, 73.8%~95.0%从阴道分离的念珠菌是白念珠菌; 非白念珠菌中最常见的是光滑念珠菌, 10%~20%的VVC由光滑念珠菌引起。白念珠菌和非白念珠菌引起的VVC在临床上很难鉴别, 特别是光滑念珠菌引起的RVVC, 往往治疗效果欠佳。
非白念珠菌引起的VVC发病率正不断增加, 特别是光滑念珠菌, 常引起RVVC。GUZEL等[9]对培养阳性的单纯性VVC、RVVC 及对照组患者的念珠菌分布进行分析, 发现白念珠菌在3类患者中分别占37.3%、54.2%、8.5%, 而非白念珠菌分别占24.1%、50.9%、25.0%, 这可能与长期单剂量唑类药物使用有关。然而, 现有的文献并不能说明这类念珠菌引起的VVC患病率有任何增加, 阴道分离的白念珠菌也不能被确定对阴道有更强的趋向性。同样, 没有证据表明, 引起VVC的菌株有更强的致病力、毒性, 这可以解释为什么完全没有阴道炎症状的妇女却有着念珠菌的广泛定植[10, 11]。引起VVC的病原体可能是由于基因活化后表型转换和毒力改变, 发生了遗传适应, 使得其能持久地存在于阴道中。念珠菌的孢子相是阴道念珠菌传播和无症状的定植形式, 在阴道炎患者中出芽生殖的孢子形成菌丝。
2.耐药性和耐药机制 临床用于治疗念珠菌病的抗真菌药物有唑类、多烯类、棘白菌素类、抗代谢药(氟胞嘧啶)等。有研究表明, 念珠菌对这些药物均存在不同程度的耐药现象[3, 4]。目前, 人们对真菌的认识处在不断深入的过程中, 由于体外药物敏感性试验缺乏统一的标准, 现有的标准又更新较快, 所以对于真菌耐药的认识不够统一。
对于念珠菌耐药机制的研究主要包括:(1)多药耐药(multidrug resistance, MDR)蛋白介导的耐药:包括ATP 结合蛋白转运盒(ATP-binding cassette, ABC)中与多药外排相关的基因CDR过度表达、易化载体超家族(major facilitator superfamily, MFS)基因MDR1的过度表达[12, 13]。(2)靶酶改变:细胞色素P450氧化酶(羊毛甾醇14α -去甲基化酶)是唑类药物作用的靶酶, 编码基因ERG11的突变和该酶的过度表达可以引起唑类药物的耐药[14]。(3)生物被膜(biofilm, BF)介导的耐药:包括膜内真菌生长速率慢、胞外聚合物基质所形成的膜屏障作用、表面诱导耐药基因的表达、膜表面甾醇代谢异常、细胞的异质性、上调外排泵基因[15, 16]。(4)Hsp90热休克蛋白介导的耐药:热休克蛋白Hsp90是一种高度保守的分子伴侣, 在靶蛋白的折叠、转运、成熟以及降解的过程中起着关键的调节作用[17]。(5)其他:包括小囊状空泡的影响和钙调神经磷酸酶通路的参与等。
三、致病机制
1.微生物致病因素 与白念珠菌致病性相关的因素主要包括芽-丝过渡、黏附蛋白、相关的蛋白酶、BF形成和表型转换。
白念珠菌是一种双相型的共生菌, 可以表现出孢子相、菌丝相的形态, 其他非白念珠菌也有相似的形态。细胞膜温度感应通过复杂的通路调节白念珠菌的形态转化和菌丝生长[18], 孢子相与念珠菌的传播相关, 而菌丝相则与念珠菌黏附、组织侵袭、蛋白水解酶活动相关, 与此相对应的基因(ALS3、SAP4-6、HWP1、HYR1和ECE1)有不同程度的活化表达。丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、环磷酸腺苷(cyclic adenosine monophosphate, cAMP)和pH传感(Rim101)信号转导通路调节细胞的形态变化、菌丝和毒力相关的基因表达[19, 20, 21]。
白念珠菌可分泌多种胞外水解酶, 已经被证实与白念珠菌毒力相关的水解酶包括分泌型天冬氨酰蛋白酶(secreted aspartyl proteinase, Sap) 、磷脂酶(phospholipase, PL)、脂肪酶(lipase, Lip)等。在这些胞外水解酶中, Sap是目前研究的重点。Sap属于天冬氨酸内肽酶类, 是由多基因家族编码的同工酶系统, 在细胞外起催化、水解蛋白质肽键的作用。根据白念珠菌Sap序列同源性将Sap家族分为Sap1-3、Sap4-6、Sap7-10, 侵袭性白念珠菌感染患者血清中的Sap2特异性IgG抗体水平明显高于正常人[22]。随着念珠菌感染率和不规范治疗带来的耐药性不断增加, 抗真菌的治疗将会是一个非常大的挑战, 由于Sap2基因疫苗可以诱导体液免疫和细胞免疫, 被认为具有广阔的临床应用前景[23]。
菌丝壁蛋白(hyphal wall protein 1, HWP1)基因和凝集样序列(agglutinin-like sequence, ALS)家族基因表达与念珠菌的黏附有关。HWP1作为外源凝集素, 是一种重要的念珠菌病致病机制, 白念珠菌ALS家族包括8个基因编码的细胞表面糖蛋白。虽然黏附功能已被证实与几个ALS蛋白相关, 但因为有基因变异和复杂的相互作用, 使他们各自的作用相当复杂。光滑念珠菌的主要黏附素为二十碳无烯酸(eicosapentaenoic acid, EPA)蛋白, EPA1基因编码的糖基(glycosylphosphatidylinositol, GPL)锚定细胞壁蛋白参与细胞黏附功能[24, 25, 26]。白念珠菌在上皮细胞上的黏附数量明显多于非白念珠菌, 所有的白念珠菌对脱落的阴道和口腔上皮细胞具有同样的黏附能力。但是, 在体外实验中, 阴道上皮细胞对念珠菌的黏附能力在人群之间有很大的变化。
BF是一种独特的微生物生存形式, 真菌BF是细胞外基质包裹下的由芽生孢子、假菌丝、菌丝等嵌入胞外聚合物形成的一种非均匀的结构, 容易在医疗器械(如导尿管和避孕环等)表面形成, 常规治疗很难清除[27]。调节白念珠菌BF形成的基因可以分成以下几类:转录因子调节基因(ACE2、BCR1、CPH1等)、细胞壁相关蛋白基因(ALS1-5、ALS7、ALS9、HWP1、HWP2等)、乙醇脱氢酶相关基因(ADH5)、蛋白激酶表达相关基因(CBK1、GIN4、IRE1、MKC1、YAK1、SMI1)、药物外排泵基因(CDR1、CDR2、MDR1)、糖化酶基因(GCA1、GCA2)等[16, 28]。白念珠菌BF的遗传研究表明, 这些基因的表达产物可以促进菌株形成稳定的菌丝, 参与BF的形成[27]。
菌落形态可以在24 ℃、富含氨基酸的琼脂上发生高频、可遗传的转化, 可变的表型可以产生菌丝和其他毒力因子[18, 29]。急性VVC患者分离的念珠菌存在高频转换模式, 这种多重表型与相关的基因表达、念珠菌的遗传不稳定性以及重复的抗真菌治疗有关[30]。虽然表型转换可以合理地解释VVC病程从无症状的定植到阴道炎的转化过程, 尚有效的证据表明这种表型的变化可以在体内37 ℃时发生。
2.诱发因素 念珠菌主要从相邻的肛门周围区域的分泌物迁徙进入阴道, 直肠和阴道定植的念珠菌有一定的同源性, 肛门— 直肠被认为是一个持续的造成阴道感染的念珠菌储存库[31, 32]。念珠菌从定植到发病与很多因素相关, 阴道微生物菌群失调是VVC的主要诱发因素, 在定植菌转换成病原菌之前, 宿主阴道环境的改变是首要条件[33]。阴道局部对念珠菌的防御机制允许无毒力的念珠菌持续存在。阴道抗念珠菌的免疫机制包括:(1)先天性免疫:阴道上皮细胞分泌甘露糖结合凝集素(mannose-binding lectin, MBL), 与受体结合激活补体系统从而抑制念珠菌的生长, 阴道内活性乳铁蛋白有抑制真菌和杀真菌的活性, 阴道内优势乳酸杆菌能抑制念珠菌的出芽, 白细胞吞噬系统具有胞内杀伤真菌并防止黏膜入侵的作用。(2)适应性免疫:念珠菌可引起宿主全身免疫应答(分泌S-IgA、IgM、IgG)和细胞介导T免疫细胞应答[34, 35, 36]。大部分妇女在她们一生中某些时间阴道会携带低浓度的念珠菌。作为正常菌群的一部分, 念珠菌在阴道以共生生物体的形式存在, 宿主并没有阴道炎的症状或体征。
虽然VVC的病原菌是单一的, 但诱发因素是多方面的。VVC的复发与多种因素有关, 宿主因素主要包括:妊娠、过敏体质、人类免疫缺陷病毒(human immunodeficiency virus, HIV)感染、未控制的糖尿病、皮质类固醇药物使用、抗菌药物应用、激素替代疗法、外阴皮肤病、会阴裂伤、肛门阴道距离短小(< 3 cm)等; 行为因素主要包括:口服避孕药、宫内节育器的使用、性交频率、会阴脱毛等[3, 9, 37]。CHAIM等[38]发现非洲裔女性VVC和ABO血型刘易斯非分泌表型相关, 可能是遗传因素使这些个体较容易发生念珠菌定植或念珠菌性阴道炎。BABULA等[39]报道基因遗传的易感性也可能造成VVC的复发。影响念珠菌阴道内定植及诱发VVC的因素主要有:(1)妊娠。孕期女性阴道内念珠菌的定植率和VVC发病率高于非孕期女性, 患病率研究显示孕期女性阴道念珠菌的定植率可以达到30%[3], 与非妊娠的女性相比, 妊娠女性在孕激素的刺激下, 阴道分泌物增加、阴道pH值升高, 更有利于念珠菌的定植, 复发频繁和对治疗应答降低以及高浓度的孕激素增加了阴道内糖原的含量, 为念珠菌提供了碳源, 雌二醇具有增强念珠菌对阴道上皮细胞黏附的能力[40, 41]。(2)糖尿病。糖尿病妇女阴道内念珠菌的定植率比非糖尿病患者高, 糖尿病患者应定期筛查生殖器念珠菌病[42]。患有Ⅱ 型糖尿病的妇女阴道内更容易定植光滑念珠菌, 因此光滑念珠菌引起的VVC发病率增加可能与Sap产量增加有关[43]。未受控制的糖尿病会诱发VVC, 血糖控制良好的糖尿病患者VVC的患病率没有显著增加[44]。从念珠菌的黏附、定植到阴道感染是一个复杂的过程, 主要依赖于性激素、阴道微生物和局部免疫微调机制。糖尿病是重要的辅助因素, 高血糖可以改变阴道微环境, 有利于念珠菌的黏附和定植, 并且还影响宿主的免疫反应, 从而促进VVC的发展。因此, 对于没有绝经而患有VVC的妇女建议进行糖耐量测试, 以发现可能的葡萄糖耐受性试验异常者。(3)抗菌药物。使用抗菌药物是VVC一个短期的风险因素, VVC患者经常局部或全身应用抗菌药物。无论是首次发作还是复发, 抗菌药物使用的持续时间与VVC的增加直接相关。抗菌药物影响了正常菌群的平衡, 导致念珠菌在胃肠道、阴道中过度生长, 从而使女性易患VVC[45, 46]。阴道内的正常菌群, 特别是乳酸杆菌可以抵抗念珠菌的定植、阻止念珠菌出芽, 使阴道中念珠菌的数量保持较低数量水平。与未患病的妇女相比, VVC妇女阴道分泌物通常可培养出较少数量的乳酸杆菌[47]。
3.宿主免疫 宿主对VVC的防御分为适应性免疫和天然免疫, 多数研究结果认为适应性免疫在阴道局部免疫所起的作用有限, 天然免疫被认为在宿主抗感染的过程中起主要作用[22, 48, 49]。甘露糖结合凝集素(mannan-binding lectin, MBL)是参与VVC的主要天然免疫机制, 其在不同人群中水平不同。目前, 普遍认为细胞介导免疫(cell-mediated immunity, CMI)是宿主抗念珠菌感染的主要防御机制, 辅助性T(helper T, Th)细胞、巨噬细胞和自然杀伤(natural killer, NK)细胞等在抗念珠菌感染中发挥了重要作用[49]。Th细胞主要分为Th1和Th2 2种, Th1产生白细胞介素(interleukin, IL)-2、干扰素(interferon, IFN)-γ 、肿瘤坏死因子(tumor necrosis factor, TNF)-β 等, 通过IL-2和IFN-γ 活化CD4+/CD8+T淋巴细胞, 增强细胞免疫应答; Th2产生IL-4、IL-5、IL-6等, IL-6能辅助B细胞分化, 从而增加IgM、IgG和IgA的分泌, 与体液免疫相关, IL-4抑制Thl的形成, Th1和Th2的调节对维持机体正常免疫功能至关重要。阴道上皮细胞分泌的人β -防御素1( human beta-defensin 1, hBD-1)、人β -防御素2(human beta-defensin 2, hBD-2)、肺表面活性物质相关蛋白A(pulmonary surfactant-associated protein A, SP-A)和Toll样受体(Toll-like receptor, TLR)在局部抗感染免疫中也起一定的作用[34, 35, 50]。
四、VVC的诊断
VVC根据临床表现(症状和体征)和实验室检查做出诊断。
1.VVC临床症状 外阴瘙痒、灼痛, 还可伴有尿痛以及性交痛等, 白带增多。
2.VVC临床体征 外阴潮红、水肿, 可见抓痕或皲裂, 小阴唇内侧及阴道黏膜附着白色膜状物, 阴道内可见较多的白色豆渣样分泌物, 可呈凝乳状。
3.实验室检查 (1)悬滴法:10%KOH镜检, 菌丝阳性率为70%~80%。生理盐水法阳性率低, 不推荐使用。(2)涂片法:革兰染色镜检, 菌丝阳性率为70%~80%。(3)培养法:复杂性VVC或有阴道炎症状但多次显微镜检查阴性者应采用培养方法, 同时进行药物敏感性试验[1, 8]。显微镜镜检主要看菌丝, 有较高的漏检率。宫颈刮片虽然特异但不敏感, 只有约25%有症状的VVC患者呈阳性[3]。临床常用的不同念珠菌培养方法相互之间没有差别, VVC的诊断需要结合相关临床表现、镜检和阴道分泌物培养综合考虑。念珠菌基因扩增、血清学或抗原检测技术可作为VVC的辅助诊断方法。
五、治疗策略
1.单纯性VVC 短疗程的局部唑类药物制剂[单剂量(氟康唑, 150 mg)1~3 d方案]可有效治疗单纯性VVC。局部应用唑类药物比制霉菌素更有效。唑类药物能有效缓解症状, 用药后80%~90%的患者念珠菌培养阴性, 达到完全治愈。单纯性VVC不通过性传播, 因此不需要性伴治疗。少数患有念珠菌性包皮龟头炎患者通过抗真菌治疗, 症状会有明显的改善。
2.重度VVC 重度VVC对短疗程治疗的临床反应较低, 应在治疗单纯性VVC方案基础上, 延长疗程。建议7~14 d局部应用唑类药物或口服150 mg氟康唑序贯治疗(初始剂量治疗后72 h给予第2剂量治疗)。症状严重者, 建议局部用低浓度糖皮质激素软膏或唑类霜剂治疗。
3.RVVC 由白念珠菌引起的RVVC适合短时间口服或局部用药治疗。然而, 为了保持临床和真菌学的控制, 一些专科医生建议:在使用抗真菌维持治疗方案之前, 初始治疗较长时间[如7~14 d的外用治疗或口服100、150或200 mg 氟康唑, 每隔3 d口服1次, 总共3个剂量(第1、4、7天)], 尝试真菌学缓解。每周口服氟康唑(100、150、200 mg剂量)维持6个月作为一线维持治疗方案。如果此方案不可行, 可考虑用局部间歇治疗方案。维持治疗可以有效减少RVVC。然而, 在维持治疗终止后, 30%~50%的妇女将有复发, 所以培养阳性、有症状的女性虽使用维持治疗也应该定期复诊。
4.非白念珠菌引起的VVC 至少有50%的患者, 非白念珠菌培养阳性而只有轻微的症状或完全没有症状, 很难治愈。医生应尽可能明确阴道感染的原因。目前还没有理想的治疗方法, 可以选择长时间(7~14 d)非唑类药物(口服或局部用药)作为一线治疗方案。如果复发, 建议用600 mg 硼酸胶囊每天用药1次, 维持2周, 可以达到约70%的清除率。再次复发建议向临床专科医生咨询。
免疫功能低下者, 如糖尿病妇女血糖控制不佳或其他免疫抑制性疾病(如HIV感染)和接受免疫抑制剂治疗(如糖皮质激素治疗)的妇女, 短期治疗对药物反应较低, 应努力纠正免疫状态, 延长常规治疗时间(7~14 d)[1, 8]。
六、结语
VVC影响着广大女性的身心健康, 但其发病率和复发率尚无统一的认识。VVC的致病机制目前尚不清楚, 很多致病因子的作用和机制是通过动物实验验证的。对宿主抗念珠菌防御机制的深入研究有助于提出有效、可行的免疫治疗方案、降低VVC的发病率和复发率。近期尚无有效的预防策略, 未来可能的治疗方法包括阴道用重组MBL以增强阴道的先天性免疫; 预防性使用阴道乳杆菌, 其能够附着于阴道上皮细胞, 长期存在于阴道, 表达抗念珠菌保护性因子等。抗念珠菌疫苗和抗体的使用已经被证明能预防啮齿动物阴道念珠菌病, 目前没有数据证明对人类有用。对人类感染的预防和控制尚待更多的基础和临床研究。
参考文献
[1] 刘朝晖, 廖秦平. 外阴阴道假丝酵母菌病(VVC)诊治规范修订稿[J]. 中国实用妇科与产科杂志, 2012, 28(6): 401-402.
[2] RATHOD SD, BUFFLER PA. Highly-cited estimates of the cumulative incidence and recurrence of vulvovaginal cand idiasis are inadequately documented[J]. BMC Womens Health, 2014, 14(1): 43.
[3] AGUIN TJ, SOBEL JD. Vulvovaginal cand idiasis in pregnancy[J]. Curr Infect Dis Rep, 2015, 17(6): 462.
[4] ZHANG JY, LIU JH, LIU FD, et al. Vulvovaginal cand idiasis: species distribution, fluconazole resistance and drug efflux pump gene overexpression[J]. Mycoses, 2014, 57(10): 584-591.
[5] FOXMAN B, MURAGLIA R, DIETZ JP, et al. Prevalence of recurrent vulvovaginal cand idiasis in 5 European countries and the United States: results from an internet panel survey[J]. J Low Genit Tract Dis, 2013, 17(3): 340-345.
[6] GOLDACRE MJ, WATT B, LOUDON N, et al. Vaginal microbial flora in normal young women[J]. Br Med J, 1979, 1(6176): 1450-1453.
[7] WATSON CJ, FAIRLEY CK, GRANDO D, et al. Associations with asymptomatic colonization with Cand ida in women reporting past vaginal cand idiasis: an observational study[J]. Eur J Obstet Gynecol Reprod Biol, 2013, 169(2): 376-379.
[8] WORKOWSKI KA, BOLAN GA. Sexually transmitted diseases treatment guidelines, 2015[J]. MMWR Recomm Rep, 2015, 64(33): 924.
[9] GUZEL AB, ILKIT M, AKAR T, et al. evaluation of risk factors in patients with vulvovaginal cand idiasis and the value of chromID Cand ida agar versus CHROMagar Cand ida for recovery and presumptive identification of vaginal yeast species[J]. Med Mycol, 2011, 49(1): 16-25.
[10] LIAN C, ZHAO J, ZHANG Z, et al. Genotype of Cand ida species associated with different conditions of vulvovaginal cand idosis[J]. Mycoses, 2004, 47(11-12): 495-502.
[11] MACURA AB, VOSS A, MELCHERS WJ, et al. Characterization of pathogenetic determinants of Cand ida albicans strains[J]. Zentralbl Bakteriol, 1998, 287(4): 501-508.
[12] PIECUCH A, OBK E. Yeast ABC proteins involved in multidrug resistance[J]. Cell Mol Biol Lett, 2014, 19(1): 1-22.
[13] HAMEED S, FATIMA Z. Novel regulatory mechanisms of pathogenicity and virulence to combat MDR in Cand ida albicans[J]. Int J Microbiol, 2013, 2013: 240209.
[14] ROGERS PD, BARKER KS. Genome-wide expression profile analysis reveals coordinately regulated genes associated with stepwise acquisition of azole resistance in Cand ida albicans clinical isolates[J]. Antimicrob Agents Chemother, 2003, 47(4): 1220-1227.
[15] TAFF HT, MITCHELL KF, EDWARD JA, et al. Mechanisms of Cand ida biofilm drug resistance[J]. Future Microbiol, 2013, 8(10): 1325-1337.
[16] DOUGLAS LJ. Cand ida biofilms and their role in infection[J]. Trends Microbiol, 2003, 11(1): 30-36.
[17] COWEN LE, LINDQUIST S. Hsp90 potentiates the rapid evolution of new traits: drug resistance in diverse fungi[J]. Science, 2005, 309(5744): 2185-2189.
[18] O'MEARA TR, COWEN LE. Hsp90-dependent regulatory circuitry controlling temperature-dependent fungal development and virulence[J]. Cell Microbiol, 2014, 16(4): 473-481.
[19] FAN Y, HE H, DONG Y, et al. Hyphae-specific genes HGC1, ALS3, HWP1, and ECE1 and relevant signaling pathways in Cand ida albicans[J]. Mycopathologia, 2013, 176(5-6): 329-335.
[20] POLVI EJ, LI X, O'MEARA TR, et al. . Opportunistic yeast pathogens: reservoirs, virulence mechanisms, and therapeutic strategies[J]. Cell Mol Life Sci, 2015, 72(12): 2261-2287.
[21] SUN Y, CAO C, JIA W, et al. pH regulates white-opaque switching and sexual mating in Cand ida albicans[J]. Eukaryot Cell, 2015, 14(11): 1127-1134.
[22] DE BERNARDIS F, ARANCIA S, SANDINI S, et al. Studies of immune responses in Cand ida vaginitis[J]. Pathogens, 2015, 4(4): 697-707.
[23] SANDINI S, LA VALLE R, DEAGLIO S, et al. A highly immunogenic recombinant and truncated protein of the secreted aspartic proteases family (rSap2t) of Cand ida albicans as a mucosal anticand idal vaccine[J]. FEMS Immunol Med Microbiol, 2011, 62(2): 215-224.
[24] ACHKAR JM, FRIES BC. Cand ida infections of the genitourinary tract[J]. Clin Microbiol Rev, 2010, 23(2): 253-273.
[25] SRIKANTHA T, DANIELS KJ, WU W, et al. Dark brown is the more virulent of the switch phenotypes of Cand ida glabrata[J]. Microbiology, 2008, 154(Pt 11): 3309-3318.
[26] RIERA M, MOGENSEN E, D'ENFERT C, et al. . New regulators of biofilm development in Cand ida glabrata[J]. Res Microbiol, 2012, 163(4): 297-307.
[27] SILVA-DIAS A, MIRANDA IM, BRANCO J, et al. Adhesion, biofilm formation, cell surface hydrophobicity, and antifungal planktonic susceptibility: relationship among Cand ida spp. [J]. Front Microbiol, 2015, 6: 205.
[28] 徐辉, 仇萌, 陈虹霞, 等. 白念珠菌生物膜及其研究进展[J]. 中国真菌学杂志, 2014, 9(4): 245-247.
[29] SOLL DR. High-frequency switching in Cand ida albicans and its relations to vaginal cand idiasis[J]. Am J Obstet Gynecol, 1988, 158(4): 997-1001.
[30] TAO L, DU H, GUAN G, et al. Discovery of a "white-gray-opaque" tristable phenotypic switching system in Cand ida albicans: roles of non-genetic diversity in host adaptation[J]. PLoS Biol, 2014, 12(4): e1001830.
[31] ARAUJO PAULO DE MEDEIROS M, VIEIRA DE MELO AP, GonCALVES SS, et al. Genetic relatedness among vaginal and anal isolates of Cand ida albicans from women with vulvovaginal cand idiasis in north-east Brazil[J]. J Med Microbiol, 2014, 63(Pt 11): 1436-1445.
[32] 高飞, 曹萍, 吴颖, 等. 外阴阴道念珠菌病复发与阴道及肛管白念珠菌定植关系的研究[J]. 皮肤病与性病, 2014, 37(3): 129-130.
[33] LIU MB, XU SR, HE Y, et al. Diverse vaginal microbiomes in reproductive-age women with vulvovaginal cand idiasis[J]. PLoS ONE, 2013, 8(11): e79812.
[34] AMOURI I, HADRICH I, ABBES S, et al. Local humoral immunity in vulvovaginal cand idiasis[J]. Ann Biol Clin(Paris), 2013, 71(2): 151-155.
[35] YANO J, NOVERR MC, FIDEL PL JR. Cytokines in the host response to Cand ida vaginitis: identifying a role for non-classical immune mediators, S10alarmins[J]. Cytokine, 2012, 58(1): 118-128.
[36] FILLER SG. Insights from human studies into the host defense against cand idiasis[J]. Cytokine, 2012, 58(1): 129-132.
[37] SOBEL JD. Recurrent vulvovaginal cand idiasis[J]. Am J Obstet Gynecol, 2016, 214(1): 15-21.
[38] CHAIM W, FOXMAN B, SOBEL JD. Association of recurrent vaginal cand idiasis and secretory ABO and Lewis phenotype[J]. J Infect Dis, 1997, 176(3): 828-830.
[39] BABULA O, LAZDANE G, KROICA J, et al. Frequency of interleukin-4(IL-4) -589 gene polymorphism and vaginal concentrations of IL-4, nitric oxide, and mannose-binding lectin in women with recurrent vulvovaginal cand idiasis[J]. Clin Infect Dis, 2005, 40(9): 1258-1262.
[40] TARRY W, FISHER M, SHEN S, et al. Cand ida albicans: the estrogen target for vaginal colonization[J]. J Surg Res, 2005, 129(2): 278-282.
[41] DENNERSTEIN GJ, ELLIS DH. Oestrogen, glycogen and vaginal cand idiasis[J]. Aust N Z J Obstet Gynaecol, 2001, 41(3): 326-328.
[42] ATABEK ME, AKYREK N, EKLIOGLU BS. Frequency of vaginal Cand ida colonization and relationship between metabolic parameters in children with type 1 diabetes mellitus[J]. J Pediatr Adolesc Gynecol, 2013, 26(5): 257-260.
[43] BASSYOUNI RH, WEGDAN AA, ABDELMonEIM A, et al. Phospholipase and aspartyl proteinase activities of Cand ida species causing vulvovaginal cand idiasis in patients with type 2 diabetes mellitus[J]. J Microbiol Biotechnol, 2015, 25(10): 1734-1741.
[44] GOSWAMI R, DADHWAL V, TEJASWI S, et al. Species-specific prevalence of vaginal cand idiasis among patients with diabetes mellitus and its relation to their glycaemic status[J]. J Infect, 2000, 41(2): 162-166.
[45] WRIGHT J, PAAUW DS. Complications of antibiotic therapy[J]. Med Clin North Am, 2013, 97(4): 667-679.
[46] WILTON L, KOLLAROVA M, HEELEY E, et al. Relative risk of vaginal cand idiasis after use of antibiotics compared with antidepressants in women: postmarketing surveillance data in England [J]. Drug Saf, 2003, 26(8): 589-597.
[47] 赵学静, 朱爱琴. 乳酸杆菌在细菌性阴道病诊断中的作用[J]. 中华医院感染学杂志, 2010, 20(7): 1023-1024.
[48] 高晓红, 朱玲. 复发性外阴阴道假丝酵母菌病与阴道免疫[J]. 中国免疫学杂志, 2014, 30(7): 985-987.
[49] 闵洁, 王敏, 赵健洁, 等. 念珠菌性阴道炎病理变化与机体免疫反应的关系[J]. 中国妇幼保健, 2009, 24(28): 4016-4018.
[50] VONK AG, NETEA MG, VAN DER MEER JW, et al. Host defence against disseminated Cand ida albicans infection and implications for antifungal immunotherapy[J]. Expert Opin Biol Ther, 2006, 6(9): 891-903. |
 |关于我们|医维基|网站地图|Archiver|手机版|医疗之家
( 沪ICP备2023001278号-1 )
|关于我们|医维基|网站地图|Archiver|手机版|医疗之家
( 沪ICP备2023001278号-1 )